
作者: 国家药监局 2022年06月06日
问:普通化妆品备案工作常用网址有哪些?
答:(1)化妆品注册备案信息服务平台(企业端)登录网址:https://zwfw.nmpa.gov.cn/web/user/login?backUrl=https://zwfw.nmpa.gov.cn/web/usercenter/index
温馨提示:未注册国家药监局网上办事大厅账号的用户,需先注册网上办事大厅法人或者经办人账号;再创建化妆品注册备案信息服务平台账号;最后点击【账号绑定】,选择授权绑定【化妆品注册备案信息服务平台】。具体操作可参照《化妆品注册备案信息服务平台用户手册-企业信息资料管理(企业用户)》(下载地址:https://www.nmpa.gov.cn/hzhp/hzhpjgdt/20210323092508104.html)
(2)国家药监局化妆品查询平台网址:https://www.nmpa.gov.cn/datasearch/home-index.html#category=hzp
(3)国产非特殊用途化妆品备案服务平台网址(旧查询平台):http://ftba.nmpa.gov.cn:8181/ftban/fw.jsp
(4)化妆品原料安全信息登记平台网址:http://ciip.nifdc.org.cn/hzpYL/ylgsInfo
(5)化妆品注册和备案检验信息管理系统网址:http://jyxt.nmpa.gov.cn:8080/jyxt/newlogin.jsp
一、系统(用户权限等)相关
问:质量安全负责人任职条件有什么要求?
答:根据《化妆品监督管理条例》第三十二条规定质量安全负责人应当具备化妆品质量安全相关专业知识,并具有5年以上化妆品生产或者质量安全管理经验。
问:质量安全负责人简历提供哪些内容?
答:根据《化妆品注册备案资料管理规定》第十三条规定质量安全负责人的简历应当包括与其要求相关的教育背景、工作经历以及其他内容。质量安全负责人相关专业知识和质量安全管理经验应当符合法律法规要求。
问:质量安全负责人能否在不同的化妆品注册人、备案人、受托生产企业兼任?
答:根据国家药监局发布的《化妆品生产经营常见问题解答(一)》,为保障化妆品质量安全,确保质量安全负责人依法落实产品质量安全管理和产品放行职责,按照“一证一人”的原则,申请两个以上(含两个)的化妆品生产许可,不得由同一个自然人担任上述企业的质量安全负责人;不同的化妆品注册人、备案人,不得由同一个自然人担任质量安全负责人。化妆品注册人、备案人与受托生产企业属于同一集团公司,执行同一质量管理体系,受托生产企业接受该注册人、备案人的委托生产化妆品时,该注册人、备案人与受托生产企业可以聘用同一个自然人担任质量安全负责人。
问:从事化妆品生产活动的化妆品注册人、备案人是否需要以“生产企业”名义另外开通账户权限?
答:根据《化妆品注册备案资料管理规定》规定,具有境内注册人或者备案人、境内责任人、生产企业等多重身份的,或者同一境内责任人对应多个境外注册人、备案人的,可以一次性提交全部相关资料,取得相应的用户权限。已有用户可以根据情况补充提供相关资料,增加用户权限。
我国境内仅从事受托生产的化妆品企业应当以“生产企业”名义开通账户权限,以便关联确认委托生产关系。
问:化妆品用户信息相关资料是否需要逐页加盖公章?
答:《化妆品注册备案资料管理规定》第五条规定化妆品注册备案资料应当符合国家有关用章规定,签章齐全,具有法律效力。境外企业及其他组织不使用公章的,应当由法定代表人或者企业(其他组织)负责人签字。除政府主管部门或者有关机构、注册和备案检验机构、公证机关等出具的资料原件外,化妆品注册备案资料均应由境内注册人、备案人或者境内责任人逐页加盖公章。
问:化妆品注册备案信息服务平台临时用户权限失效,如何解决?
答:按照《国家药监局关于做好新旧化妆品注册备案信息管理平台衔接有关工作事项的通知》(药监综妆函〔2021〕264号)要求,已开通新平台临时用户权限的化妆品注册人、备案人、境内责任人,应当于2022年1月1日前补充提交质量管理体系概述、不良反应监测和评价体系概述等资料。逾期未补充提交相关资料的,其临时用户权限自2022年1月1日起自动失效,无法登录“普通化妆品备案管理”模块,需使用“企业信息资料管理模块”补充相关资料,经省级药品监管部门审核并开通完整权限后,方可办理相关业务。
2022年1月15日起,临时用户权限的账号,可使用“普通化妆品备案管理”模块查看2021年12月31日前已提交的业务进展。
问:为什么已备案产品显示“异常”?
答:根据《国家药监局关于实施<化妆品注册备案资料管理规定>有关事项的公告》(2021年第35号)要求,自2022年1月1日起,通过原注册备案平台和新注册备案平台备案的普通化妆品,统一实施年度报告制度。备案人应当于每年1月1日至3月31日期间,通过新注册备案平台,提交备案时间满一年普通化妆品的年度报告。目前,2022年3月31日前未按要求完成年报的产品(2021年1月1日前备案的产品)在普通化妆品信息公示平台已公示:“异常!备案人未按法规要求进行年度报告。”监管部门将对相关产品陆续出具限期改正意见。
二、产品备案相关
问:如何规范填报化妆品备案产品名称命名依据?
答:根据《化妆品注册备案资料管理规定》第二十八条规定:“注册人、备案人应当提交产品名称命名依据,产品名称命名依据中应当指明商标名、通用名、属性名,并分别说明其具体含义”。
问:仅供出口的化妆品,如何进行备案?
答:由生产企业向平台提交以下资料:一是产品名称;二是拟出口国家(地区);三是产品标签图片,包括产品销售包装正面立体图、产品包装平面图和产品说明书(如有)。
问:进口普通化妆品如何变更产品中文名称?
答:已经备案的进口普通化妆品,无正当理由不得随意改变产品名称。依据:《化妆品注册备案管理办法》第三十六条。目前按照国家药监局普通化妆品备案管理系统的统一设置,产品名称变更事项需在产品备案资料整理完成后方能提出申请。
问:进口普通化妆品的备案管理部门改变,应该如何再次备案?
答:备案人、境内责任人地址变化导致备案管理部门改变的,备案人应当重新进行备案。普通产品注销后再次备案时,应当提交情况说明。对于非安全性原因注销的,再次申请备案时可使用原备案资料的复印件。依据:《化妆品注册备案管理办法》第三十六条、《化妆品注册备案管理办法》第五十九条.
问:已获行政许可的进口普通化妆品如何进行备案?
答:2018年11月10日前已获行政许可的产品,许可有效期结束后仍需继续进口的,或者有效期结束前原行政许可事项发生变更的,应当在有效期届满5个工作日前,或变更产品上市之前,按照要求办理备案,备案完成后原纸质版凭证自动失效。境内责任人与原在华申报责任单位为不同的企业法人时,还应当同时提交原在华申报责任单位签署的知情同意书。原行政许可申报资料中的产品检验报告、安全性评估资料以及相关证明性文件等可作为备案资料提交,相关资料原件已随原行政许可申请提交无法获取的,可提供复印件并加盖境内责任人的公章,同时提交相关情况说明。依据:国家药品监督管理局发布的《化妆品监督管理常见问题解答(一)》。
问:旧系统产品如何进行注销操作?
答:由于旧系统产品只会迁移到新系统备案人(原委托方)账号下,因此产品注销应由备案人(原委托方)进行操作。
(1)备案人(原委托方)如有新系统账号可申请主动注销;
(2)备案人(原委托方)如无新系统账号可向所在地监管部门(区市场监管局)申请注销。
问:境外委托境内生产的化妆品应如何备案,仅供出口的应如何备案?
答:根据《化妆品监督管理条例》第二十三条,境外化妆品注册人、备案人应当指定我国境内的企业法人办理化妆品注册、备案,协助开展化妆品不良反应监测、实施产品召回。境外委托境内生产普通化妆品的,境外备案人应指定我国境内的企业法人作为境内责任人,境内责任人在普通化妆品备案管理系统注册境内责任人角色并通过后方可办理境外委托境内产品的备案工作。
根据《化妆品注册备案资料管理规定》第三十七条,仅供出口的特殊化妆品和普通化妆品,应当在注册备案信息服务平台进行备案,由生产企业提交以下资料:
(1)产品名称;
(2)拟出口国家(地区);
(3)产品标签图片,包括产品销售包装正面图、产品包装平面图和产品说明书(如有)。
问:进口普通化妆品的施用部位为颈部,作用部位分类编码应该如何选择?
答:施用部位为“颈部”的进口普通化妆品的作用部位分类编码建议选择为“03躯干部位”。依据:《化妆品分类规则和分类目录》第六条及附表2。
问:产品备案时,销售包装可以同时上传多款吗?上传几个附件?
答:根据《化妆品注册备案资料管理规定》第三十二条的要求,存在多种销售包装的,应当提交所有的销售包装的标签图片。符合以下一种或多种情形的,提交其中一种销售包装的标签图片,其他销售包装的标签图片可不重复上传:
1.仅净含量规格不同的;
2.仅在已上传销售包装上附加标注销售渠道、促销、节日专款、赠品等信息的;
3.仅销售包装颜色存在差异的;
4.已注册或者备案产品以套盒、礼盒等形式组合销售,组合过程不接触产品内容物,除增加组合包装产品名称外,其他标注的内容未超出每个产品标签内容的;
5.通过文字描述能够清楚反映与已上传销售包装差异,并已备注说明的。
所有销售包装的平面图/立体图应分别整理成一个附件,并分别上传至销售包装平面图/销售包装立体图处。
问:分段生产的产品,标签上如何标注生产企业?
答:根据《化妆品标签管理办法》第十条的要求,化妆品注册人、备案人、境内责任人和生产企业的名称、地址等相关信息,应当按照下列规定在产品销售包装可视面进行标注:
(一)注册人、备案人、境内责任人和生产企业的名称和地址,应当标注产品注册证书或者备案信息载明的企业名称和地址,分别以相应的引导语引出;
(二)化妆品注册人或者备案人与生产企业相同时,可使用“注册人/生产企业” 或者“备案人/生产企业”作为引导语,进行简化标注;
(三)生产企业名称和地址应当标注完成最后一道接触内容物的工序的生产企业的名称、地址。注册人、备案人同时委托多个生产企业完成最后一道接触内容物的工序的,可以同时标注各受托生产企业的名称、地址,并通过代码或者其他方式指明产品的具体生产企业;
(四)生产企业为境内的,还应当在企业名称和地址之后标注化妆品生产许可证编号,以相应的引导语引出。
问:试用装、体验装还需要备案吗?
答:根据《化妆品标签管理办法》第二十一条的要求,以免费试用、赠予、兑换等形式向消费者提供的化妆品,其标签适用本办法。
试用装、体验装也需要备案。
问:进口普通化妆品的内包装上必须有中文名称吗?
答:根据《国家药监局关于发布实施〈化妆品标签管理办法〉的公告》(2021年第77号),2022年5月1日起,申请注册或者进行备案的化妆品,必须符合《化妆品标签管理办法》的规定和要求。具有包装盒的进口普通化妆品,应当同时在直接接触内容物的包装容器上标注产品中文名称和使用期限。
三、产品配方相关
问:化妆品原料安全信息登记平台上线后是否只能通过原料报送码关联原料信息?
答:化妆品原料安全信息登记平台上线后,化妆品注册人、备案人、境内责任人仍可以通过化妆品注册备案信息服务平台填报原料生产商出具的原料安全信息文件,也可以填写化妆品原料安全信息登记平台生成的原料报送码关联原料安全信息文件。
问:如何填报化妆品原料的安全相关信息?
答:根据国家药监局《化妆品原料安全信息登记平台上线通知》,普通化妆品备案人可选择以下方式填报原料安全相关信息:(1)通过化妆品注册备案信息服务平台内的原料信息维护模块填报原料安全相关信息;(2)原料生产商或其授权企业已在国家药监局化妆品原料安全信息登记平台报送化妆品原料安全相关信息的,普通化妆品备案人可填写原料报送码关联原料安全信息文件。化妆品备案原料信息填报要求:
问:如何在化妆品原料安全信息登记平台报送化妆品原料安全相关信息?
答:境内用户直接通过国家药监局网上办事大厅(https://zwfw.nmpa.gov.cn)的“化妆品原料安全信息登记平台”模块进行登陆化妆品原料安全信息登记平台进行填报化妆品原料安全相关信息;境外用户需在“化妆品原料安全信息登记平台”(http://ciip.nifdc.org.cn)开通账号后登陆化妆品原料安全信息登记平台填报化妆品原料安全相关信息。
问:原料安全相关信息包括哪些内容?
答:原料安全相关信息应当包括原料商品名、原料基本信息、原料生产工艺简述、必要的质量控制要求、国际权威机构评估结论、风险物质限制要求等,
问:如何定义原料生产商?原料经销商是否可通过化妆品原料安全信息登记平台报送化妆品原料安全相关信息?
答:原料生产商是指对原料安全承担责任的企业,可以是原料的实际生产企业、与原料实际生产企业隶属同一集团公司的关联企业或者原料委托生产行为中的委托企业。原料经销商根据实际情况判断是否符合原料生产商定义。
原料经销商若同时为原料生产商,则可自行报送化妆品原料安全信息;若非原料生产商,则可作为被授权企业,在提交化妆品原料生产商出具的授权书后,开通化妆品原料安全信息报送权限。
问:着色剂在化妆品备案管理系统应如何填报?标签应如何标注?
答:使用着色剂的,应当在系统“产品配方”原料名称栏标明《化妆品安全技术规范》载明的CI号,产品标签上标注CI号,无CI号的除外。既能做着色剂,又能以其他目的使用的成分,如二氧化钛、云母、氧化锌等,其用作其他使用目的时,系统“产品配方”原料名称及标签标注应为标准中文名称。
问:哪些原料属于《化妆品安全技术规范》有质量规格要求的原料?
答:根据《国家药监局关于实施<化妆品注册备案资料管理规定>有关事项的公告(2021年第35号)》要求,自2021年5月1日起,注册人备案人申请注册或者进行备案时,应当填报产品配方原料的来源和商品名信息,其中涉及《化妆品安全技术规范》中有质量规格要求的原料,还应当提交原料的质量规格证明或者安全相关信息。
《化妆品安全技术规范》有质量规格要求的原料包括但不限于:聚丙烯酰胺类、三链烷胺,三链烷醇胺及它们的盐类、二氯甲烷、脂肪酸双链烷酰胺及脂肪酸双链烷醇酰胺、单链烷胺,单链烷醇胺及它们的盐类等,以上原料的具体规格要求可参考《化妆品安全技术规范》表3“化妆品限用组分”中的“其他限制和要求”。
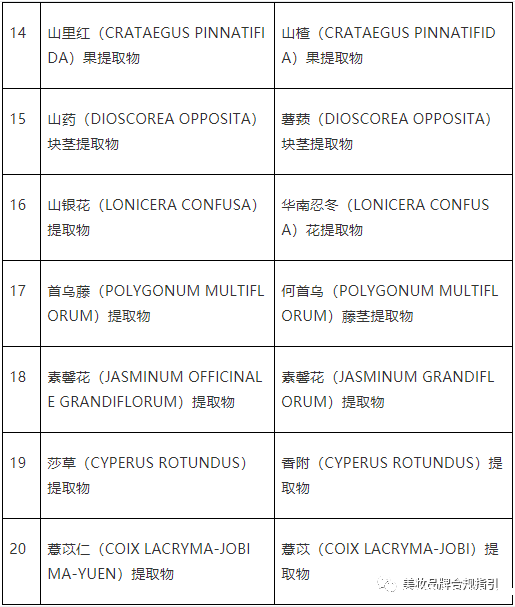
问:对比《已使用化妆品原料目录》(2015版),《已使用化妆品原料目录》(2021版)中哪些原料更新了中文名称?
答:《已使用化妆品原料目录》(2015版)中存在同一原料有多个中文名称的情况,《已使用化妆品原料目录》(2021版)将同一原料的名称进行了规范统一,具体清单见下表。自2021年5月1日起,备案人进行化妆品备案的,应当使用《已使用化妆品原料目录》(2021版)规范后的原料名称。


问:《已使用化妆品原料名称目录》(2021版)中的哪些原料新纳入禁用物质管理?
答:根据《国家药监局关于更新化妆品禁用原料目录的公告》(2021年第74号),《已使用化妆品原料目录》(2021版)中17个原料于2021年5月28日起新纳入禁用组分管理:甲醛、硼酸、硼砂、2-氯对苯二胺、2-氯对苯二胺硫酸盐、大麻(CANNABIS SATIVA)仁果、大麻(CANNABIS SATIVA)籽油、大麻(CANNABIS SATIVA)叶提取物、万寿菊(TAGETES ERECTA)花提取物、乙酸乙烯酯等。
以上17种原料在2021年第74号公告前,部分属于限用组分、部分属于准用组分、部分属于已使用原料,各生产企业应严格按照公告要求,不得再生产、进口产品配方中使用了上述禁用原料的化妆品。
问:填报原料报送码有哪些注意事项?
答:目前发现化妆品备案管理系统提示部分化妆品备案填报的原料报送码与原料安全信息登记平台数据不一致的情况。备案人应与原料生产商(供应商)核实:
(1)原料报送码是否对应目标原料;
(2)化妆品配方中具体原料,如复配原料的组成、配比是否与原料安全信息登记平台填报的信息一致。
问:原料报送码是否可以报送多个?
答:按照普通化妆品备案管理系统2022年3月14日《关于普通化妆品备案管理系统升级公告》,普通化妆品备案管理系统支持一个原料填报多个原料报送码。
问:产品配方申报时系统有多个备注栏如何填写?
答:每个原料后备注栏是对单个原料情形的备注,如:使用变性乙醇的,应当说明变性剂的名称及用量;使用类别原料的,应当说明具体的原料名称;直接来源于植物的,应当说明原植物的具体使用部位等。
整个配方表下方备注栏是对于产品的整体情况备注,如产品是否含有推进剂。
使用贴、膜类载体材料的,应勾选相应选项,并在对应说明栏中注明主要载体材料的材质组成,同时上传其来源、制备工艺、质量控制指标等资料。
问:来源于石油煤焦油的碳氢化合物有哪些?
答:一般可包括矿油、矿脂、石蜡、微晶蜡、地蜡、纯地蜡、液体石蜡、C13-16 异链烷烃、C13-14 异链烷烃、C10-11 异链烷烃、C10-12 烷/环烷、C10-12 异链烷烃、C10-13 异链烷烃、C11-12 异链烷烃、C11-13 异链烷烃、C12-14 异链烷烃、C12-15 异链烷烃、C12-20 异链烷烃、C13-14 烷、C13-15 烷、C15-19 烷、C15-23烷、C18-21 烷、C7-8 异链烷烃、C8-9 异链烷烃、C9-11 异链烷烃、C9-12 烷、C9-13 异链烷烃等。
使用来源于石油、煤焦油的碳氢化合物(单一组分除外)的,应当在普通化妆品备案管理系统的产品配方表备注栏中标明相关原料的化学文摘索引号(简称CAS号)。
问:含量0.1%以下原料在备案系统配方填报时是否应按照降序排列?
答:是的。根据《化妆品注册备案资料管理规定》要求,产品配方应当提供全部原料的含量,含量以质量百分比计,全部原料应当按含量递减顺序排列,因此,含量0.1%以下的原料也应按照要求降序排列。
另外,根据《化妆品标签管理办法》,在标签上所有不超过0.1%(w/w)的成分应当以“其他微量成分”作为引导语引出另行标注,可以不按照成分含量的降序列出。
问:进口普通化妆品需要补充检测二惡烷指标时,应当注意哪些事项?
答:配方中含有乙氧基结构原料的进口普通化妆品,应当检测二惡烷。同一产品的注册或备案检验项目,一般应当由同一检验检测机构独立完成并出具检验报告。
依据:《化妆品注册和备案检验工作规范》第十条及附1。
化妆品注册备案检验机构可在国家药品监督管理局官方网站→化妆品→化妆品注册和备案检验检测机构中查询。
问:配方中含有纳米原料,配方表中应当如何标注?
答:应按照《化妆品注册备案资料管理规定》要求,在纳米原料名称后标注“(纳米级)”。
问:产品配方含水杨酸,使用目的不是防腐剂,在产品标签上需要标注哪些相关内容?
答:经查询,水杨酸是《化妆品安全技术规范》(2015年版)中化妆品限用组分(表3)第8号组分。综合(表3)中要求,(1)标签上必须标印的使用条件和注意事项为“含水杨酸;三岁以下儿童勿用(仅当产品有可能为三岁以下儿童使用,并与皮肤长期接触时)”;(2)作为防腐剂使用时,具体要求见防腐剂表4 的规定;如果使用目的不是防腐剂,该原料及其功能还必须标注在产品标签上。标签上标注的原料功能应与配方中该原料的使用目的相对应。
问:使用贴、膜类载体材料的产品,应当如何填报?
答:应勾选配方表下“是否膜质载体材料”选项,并按照《化妆品注册备案资料管理规定》要求备注说明主要载体材料的材质组成,同时提供其来源、制备工艺、质量控制指标等资料。
备案申请表中,产品剂型分类编码应包含“10 贴、膜、含基材”。
问:产品配方含有与产品内容物直接接触的推进剂的,应当如何进行推进剂的填报?
答:应按照《化妆品注册备案资料管理规定》要求,在配方表下方作推进剂相关信息的单独填报,推进剂含量合计应为100%。
备案申请表中,产品剂型分类编码应包含“09 气雾剂”。
问:化妆品原料中添加的如抗氧化剂、防腐剂、稳定剂等保护原料的成分,是否应当在产品标签上进行标注?
答:《化妆品注册备案管理办法》规定化妆品标签应当在销售包装可视面标注化妆品全部成分的原料标准中文名称。
化妆品成分是指生产过程中有目的地添加到产品配方中,并在最终产品中起到一定作用的成分。为了保证化妆品原料质量而在原料中添加的极其微量的抗氧化剂、防腐剂、稳定剂等成分,虽然在申请注册或者进行备案时以该原料复配的形式进行产品配方填报,但不属于化妆品的成分,可以不在产品标签上进行标注;当然企业为保障消费者知情权,也可以在产品标签进行标注。
问:化妆品备案过程中,原料报送码与原料安全信息文件两者是否均需提交?
答:两者选其一。为了促进我国化妆品行业的原料安全管理水平,国家药监局组织建立化妆品原料安全信息报送平台,化妆品原料生产商或其授权企业可以登录该平台报送原料安全相关信息,生成原料报送码。其中,境内用户直接通过国家药监局网上办事大厅(https://zwfw.nmpa.gov.cn)的“化妆品原料安全信息登记平台”模块进行登录;境外用户需在“化妆品原料安全信息登记平台”(http://ciip.nifdc.org.cn)开通账号后登录。化妆品备案人/境内责任人可仅填报原料生产商提供的原料报送码,由平台进行关联,无需重复填报详细的原料安全信息。
若尚无原料报送码,化妆品备案人/境内责任人可根据原料生产商出具的原料安全信息文件,在化妆品注册备案平台填写并上传原料安全相关信息。
问:原料安全相关信息应注意哪些事项?
答:1.原料安全相关信息填报应参照《化妆品注册备案资料管理规定》附14 原料安全相关信息。2.若原料属于《化妆品安全技术规范(2015年版)》表3-表7中有限制要求的原料,原料安全相关信息应说明限制指标的情况。3由备案人/境内责任人自行上传原料安全相关信息文件时,应根据《化妆品注册备案资料管理规定》要求,逐页加盖备案人/境内责任人公章。
四、产品执行标准相关
问:产品执行的标准如何填报?
答:《化妆品注册备案资料管理规定》第三十条规定,产品执行的标准包括全成分、生产工艺简述、感官指标、微生物和理化指标及其质量控制措施、使用方法、贮存条件、使用期限等内容,应当符合国家有关法律法规、强制性国家标准和技术规范的要求。
问:产品标签上产品执行的标准编号如何标注?
答:产品执行的标准编号与备案号一致,可以在备案系统中预置,用于产品标签。
问:使用贴、膜类载体材料的产品的感官指标应如何描述?
答:根据《化妆品注册备案资料管理规定》第三十条(四):感官指标。应当分别描述产品内容物的颜色、性状、气味等指标。使用贴、膜类载体材料的产品应当分别描述贴、膜类材料以及浸液的颜色、性状等。
问:微生物和理化指标的质量控制措施中采用的检验方法与《化妆品安全技术规范》不一致的,应如何填写?
答:根据《化妆品注册备案资料管理规定》第三十条(五):3. 采用检验方式作为质量控制措施的,所用方法与《化妆品安全技术规范》所载方法不一致的,应当填写检验方法名称,说明该方法是否与《化妆品安全技术规范》所载方法开展过验证,完整的检验方法和方法验证资料留档备查
问:产品执行的标准中采用非检验方式作为质量控制措施的,应注意哪些系统填报要点?
答:根据《化妆品注册备案资料管理规定》要求,采用非检验方式作为质量控制措施的,应当明确具体的实施方案,对质量控制措施的合理性进行说明,以确保产品符合《化妆品安全技术规范》要求。系统填报可参考《化妆品注册备案资料管理规定》附16的表3及其备注。
问:生产工艺简述中是否可以免除罐装步骤?
答:不可以。根据《化妆品注册备案资料管理规定》第三十条要求,生产工艺简述应当简要描述实际生产过程的主要步骤,包括投料、混合、灌装等。如有冻干等工艺的也应按照实际生产工艺进行描述。
问:进口普通化妆品备案资料(四)产品执行的标准中“微生物指标和理化指标”应该如何填写?
答:(1)应当如实提交对产品实际控制的项目指标,项目指标在符合《化妆品安全技术规范》《化妆品注册和备案检验工作规范》要求的基础上,应不低于原产国(地区)的质量控制要求。
(2)应当根据产品实际控制的微生物和理化指标提交相应的质量控制措施。
(3)采用检验方式作为质量控制措施的,应当注明检验频次,所用方法与《化妆品安全技术规范》所载方法完全一致的,应当填写《化妆品安全技术规范》的检验方法名称;与《化妆品安全技术规范》所载方法不一致的, 应当填写检验方法名称,说明该方法是否与《化妆品安全技术规范》所载方法开展过验证,完整的检验方法和方法验证资料留档备查。
(4)采用非检验方式作为质量控制措施的,应当明确具体的实施方案,对质量控制措施的合理性进行说明,以确保产品符合《化妆品安全技术规范》要求。
依据:根据《化妆品注册备案资料管理规定》第三十条(五)。
问:进口普通化妆品是否可以免于提交毒理学试验报告?
答:普通化妆品的生产企业已取得所在国(地区)政府主管部门出具的生产质量管理体系相关资质认证,且产品安全风险评估结果能够充分确认产品安全性的,可免于提交该产品的毒理学试验报告,有下列情形的除外:(1)产品宣称婴幼儿和儿童使用的;(2)产品使用尚在安全监测中化妆品新原料的;(3)根据量化分级评分结果,备案人、境内责任人、生产企业被列为重点监管对象的。
有多个生产企业生产的,所有生产企业均已取得所在国(地区)政府主管部门出具的生产质量管理体系相关资质认证的,方可免于提交毒理学试验报告。
依据:《化妆品注册备案资料管理规定》第三十三条(二)。
五、检验报告相关
问:进口普通化妆品需要补充检测二惡烷指标时,应当注意哪些事项?
答:配方中含有乙氧基结构原料的进口普通化妆品,应当检测二惡烷。同一产品的注册或备案检验项目,一般应当由同一检验检测机构独立完成并出具检验报告。
问:检验报告中的产品名称、送检人与产品注册备案信息不一致的情况如何处理?
答:根据《化妆品注册备案资料管理规定》第三十三条(一):2.产品检验报告中载明的产品信息应当与注册或者备案产品相关信息保持一致。由于更名等原因,导致检验报告中产品名称、企业名称等不影响检验结果的信息与注册备案信息不一致的,应当予以说明,并提交检验报告变更申请表和检验检测机构出具的补充检验报告或者更正函。
问:普通化妆品备案时,不同包装类型、各部分配方不同、且只有一个产品名称的样品,应该如何检验?
答:根据《化妆品注册和备案检验工作规范》附1《化妆品注册和备案检验项目要求》应按以下规定进行检验:
(一)微生物项目,若一个样品包装内各部分为独立包装,应当分别检验;若一个样品包装内各部分为非独立包装,应混合取样检验。若产品为不同类别的彩妆组合,应分别检验。
(二)理化项目应当按各部分分别检验;若无法分别取样,且不涉及配方原料含量相关检验项目的,可以按说明书中使用方法检验;若涉及配方原料含量相关检验项目的,可由企业提供包装前的半成品进行检验,取样方式应当在检验报告中予以说明。
(三)毒理学试验、人体安全性与功效评价检验可按照说明书中使用方法进行检验;当存在各部分单独使用的可能性时,应当分别检验。
问:普通化妆品中添加化学防晒剂的,应进行哪些检验?
答:根据《化妆品注册和备案检验工作规范》附1《化妆品注册和备案检验项目要求》:配方中含有化学防晒剂的非防晒类产品,需检测所含化学防晒剂。化学防晒剂含量≥0.5%(w/w)的产品(淋洗类、香水类、指甲油类除外),还应进行皮肤光毒性试验和皮肤变态反应试验。非防晒类化妆品中化学防晒剂含量之和≥0.5%(w/w)的产品(淋洗类、香水类、指甲油类除外),需要检测SPF值。
六、化妆品功效宣称相关
问:化妆品功效宣称依据的摘要需要填报哪些内容?
答:根据《化妆品功效宣称评价规范》第十九条规定:化妆品功效宣称依据的摘要应当简明扼要地列出产品功效宣称依据的内容,至少包括以下信息:
(一)产品基本信息;
(二)功效宣称评价项目及评价机构;
(三)评价方法与结果简述;
(四)功效宣称评价结论,应当阐明产品的功效宣称与评价方法与结果之间的关联性。
问:能够通过感官直接识别或仅通过物理方式发生效果的化妆品如何在备案系统上操作免予公布产品功效宣称依据的摘要?
答:根据《化妆品功效宣称评价规范》第四条规定:化妆品注册人、备案人在申请注册或进行备案的同时,应当按照本规范要求,在国家药品监督管理局指定的专门网站上传产品功效宣称依据的摘要。
免予公布产品功效宣称依据的摘要的产品需要在普通化妆品备案管理系统中的“功效宣称”模块进行产品功效宣称填报,根据产品的分类编码,在“产品功效宣称”项目填报功效名称,并在“是否免予”一栏勾选“是”,“备注”栏将自动显示“根据《化妆品功效宣称评价规范》,能够通过视觉、嗅觉等感官直接识别的,可免予公布产品功效宣称依据的摘要”的说明,然后提交功效宣称。
问:功效宣称摘要填报错误是否可以撤回修改?
答:功效宣称摘要资料提交后无法撤回,备案人可以再次编写功效宣称摘要资料重新提交,公示系统将公示最新提交的功效宣称摘要内容。备案人所有提交的功效宣称摘要资料将留存系统备查。
问:功效宣称评价是否一定需要第三方开展?功效宣称评价机构需要满足什么条件?
答:根据《化妆品功效宣称评价规范》要求,化妆品注册人、备案人可以自行或者委托具备相应能力的评价机构,按照化妆品功效宣称评价项目要求,开展化妆品功效宣称评价。承担化妆品功效宣称评价的机构应建立良好的实验室规范,完成功效宣称评价工作和出具报告,并对出具报告的真实性、可靠性负责。
具有祛斑美白、防晒和防脱发功效的化妆品,应当由化妆品注册和备案检验机构按照强制性国家标准、技术规范的要求开展人体功效评价试验,并出具报告。
问:宣称物理去角质、物理去黑头的产品如何填报产品功效宣称?
答:根据《化妆品功效宣称评价规范》要求,通过简单物理遮盖、附着、摩擦等方式发生效果,如物理方式去角质和物理方式去黑头等,且在标签上明确标识仅具物理作用的功效宣称,可免予公布产品功效宣称依据的摘要。
产品分类编码选择了“去角质”“祛痘”后,需在普通化妆品备案管理系统【产品标签】板块选择“是[本产品去角质作用是通过简单物理方式发生效果,且应在标签上明确标识仅具物理作用]”或“是[本产品“祛痘”仅限于去黑头作用,通过简单物理方式发生效果,且应在标签上明确标识仅具物理作用]”,再在普通化妆品备案管理系统【功效宣称】板块“是否免予”处选择“是”。